Por Carla Maleita1,2, Ivânia Esteves2, Isabel Abrantes2
1 Centro de Investigação em Engenharia dos Processos Químicos e dos Produtos da Floresta, Faculdade de Ciências e Tecnologia, Departamento de Engenharia Química, Universidade de Coimbra (FCT – UC)
2 Centre for Functional Ecology-Science for People & the Planet, Faculdade de Ciências e Tecnologia, Departamento de Ciências da Vida (NEMATO-lab – UC)
RESUMO
O impacto dos nemátodes parasitas de plantas em culturas economicamente importantes e a crescente preocupação com o ambiente e a saúde humana tem motivado o desenvolvimento de novos métodos de deteção, identificação, e estratégias de controlo amigas do ambiente. A identificação nematológica fundamentada em caracteres morfobiométricos deve ser complementada com metodologias moleculares precisas, rápidas e fiáveis. O desenvolvimento de estratégias baseadas na utilização de práticas culturais, agentes biológicos e nematodicidas naturais têm cada vez mais relevância no controlo de nemátodes das galhas radiculares e de nemátodes das lesões radiculares.
Palavras-chave: Controlo, Deteção, Nemátodes das galhas radiculares, Nemátodes das lesões radiculares, Sustentabilidade.
ABSTRACT
The impact of plant-parasitic nematodes on economically important crops and the growing concern for the environment and human health has motivated the development of new methods of detection, identification, and environmentally friendly control strategies. The nematological identification built on morphobiometric characters should be complemented with precise, fast and reliable molecular methodologies. The development of strategies based on the use of cultural practices, biological agents, and natural nematicides are relevant for the control of root knot and root lesion nematodes.
Keywords: Control, Detection, Root knot nematodes, Root lesion nematodes, Sustainability.

INTRODUÇÃO
Com o crescente aumento da população mundial, prevê-se que a produção alimentar global terá que aumentar entre 40 a 54% até 2050, de forma a alimentar uma população de 10 biliões de pessoas, o que se traduz num enorme desafio para o setor agroalimentar (FAO, 2018). Um dos principais obstáculos deste setor é a ocorrência de pragas e doenças.
De acordo com a Organização Europeia e Mediterrânica para a Proteção das Plantas (EPPO, 2020), onze espécies de nemátodes parasitas de plantas (NPP) fazem parte da lista A2 de pragas recomendadas para regulamentação como sendo de quarentena: Aphelenchoides besseyi, Ditylenchus dipsaci, Globodera pallida, G. rostochiensis, Heterodera glycines, Meloidogyne chitwoodi, M. enterolobii, M. fallax, M. mali, Radopholus similis e Xiphinema rivesi. Destes, os nemátodes de quisto da batateira (G. pallida e G. rostochiensis) e duas espécies de nemátodes das galhas radiculares (NGR, M. chitwoodi e M. enterolobii) já foram identificados em Portugal.
Outras espécies, apesar de não configurarem na lista das pragas recomendadas para quarentena, causam preocupação pelo elevado potencial destrutivo que podem causar em culturas agrícolas economicamente importantes. É o caso da espécie de NGR, M. luci, detetada em Portugal em batateira e tomateiro (Maleita et al., 2018; Santos et al., 2019) e de algumas espécies de nemátodes das lesões radiculares (NLR, Pratylenchus spp.).
Apesar dos NLR não configurarem na lista da EPPO, a instalação de parcelas de plantas mãe para a produção de materiais de propagação e de plantação de macieiras e pereiras, pode ser condicionada se for detetada a presença de P. penetrans ou P. vulnus (DL nº 82/17). Deste modo, o desenvolvimento de novos métodos de diagnóstico e estratégias mais sustentáveis para o controlo dos NGR e NLR tem vindo a merecer a atenção de muitos investigadores.
DETEÇÃO E IDENTIFICAÇÃO
A deteção e identificação de espécies de NGR e NLR são fundamentais para delinear procedimentos que evitem a sua disseminação e definir estratégias de controlo. Dessa forma, e considerando o impacto destes NPP na produção agrícola, têm vindo a ser desenvolvidos métodos diagnósticos mais precisos, rápidos e fiáveis.
No passado, a sua identificação baseava-se apenas na análise morfobiométria com recurso a técnicas de microscopia, como por exemplo o padrão perineal de fêmeas de NGR (Figura 1A) e caracteres da cabeça e cauda dos NLR (Figura 1C). Contudo, a elevada variabilidade e o grande número de espécies descritas dificultam a sua identificação, mesmo para técnicos mais qualificados. Por isso, a utilização de técnicas complementares, baseadas na análise do material genético (ADN), tem sido fundamental. No caso dos NGR, além das técnicas moleculares, a análise de enzimas (análise bioquímica), sobretudo esterases (Figura 1B), continua a ser o primeiro passo na sua identificação, sendo muito útil na deteção e identificação de populações com mais do que uma espécie (Pais e Abrantes, 1989; Carneiro et al., 2017).
No entanto, esta metodologia aplica-se apenas a fêmeas havendo interesse em recorrer a metodologias que possibilitem a utilização de outros estádios do ciclo de vida. Assim, através da análise do ADN, é possível analisar vários genes e a identificação é estável em qualquer fase do desenvolvimento dos nemátodes.
As técnicas moleculares, usando sobretudo marcadores específicos para cada espécie e a amplificação de genes específicos, são consideradas boas alternativas para a identificação de NPP devido à rapidez em obter os resultados, fiabilidade, podendo ser realizadas por investigadores não especializados em taxonomia. O fragmento de ADN obtido e visualizado em gel de agarose é específico da espécie (Figura 1D), permitindo a identificação e diferenciação da espécie de nemátodes presente no solo ou em raízes infetadas.
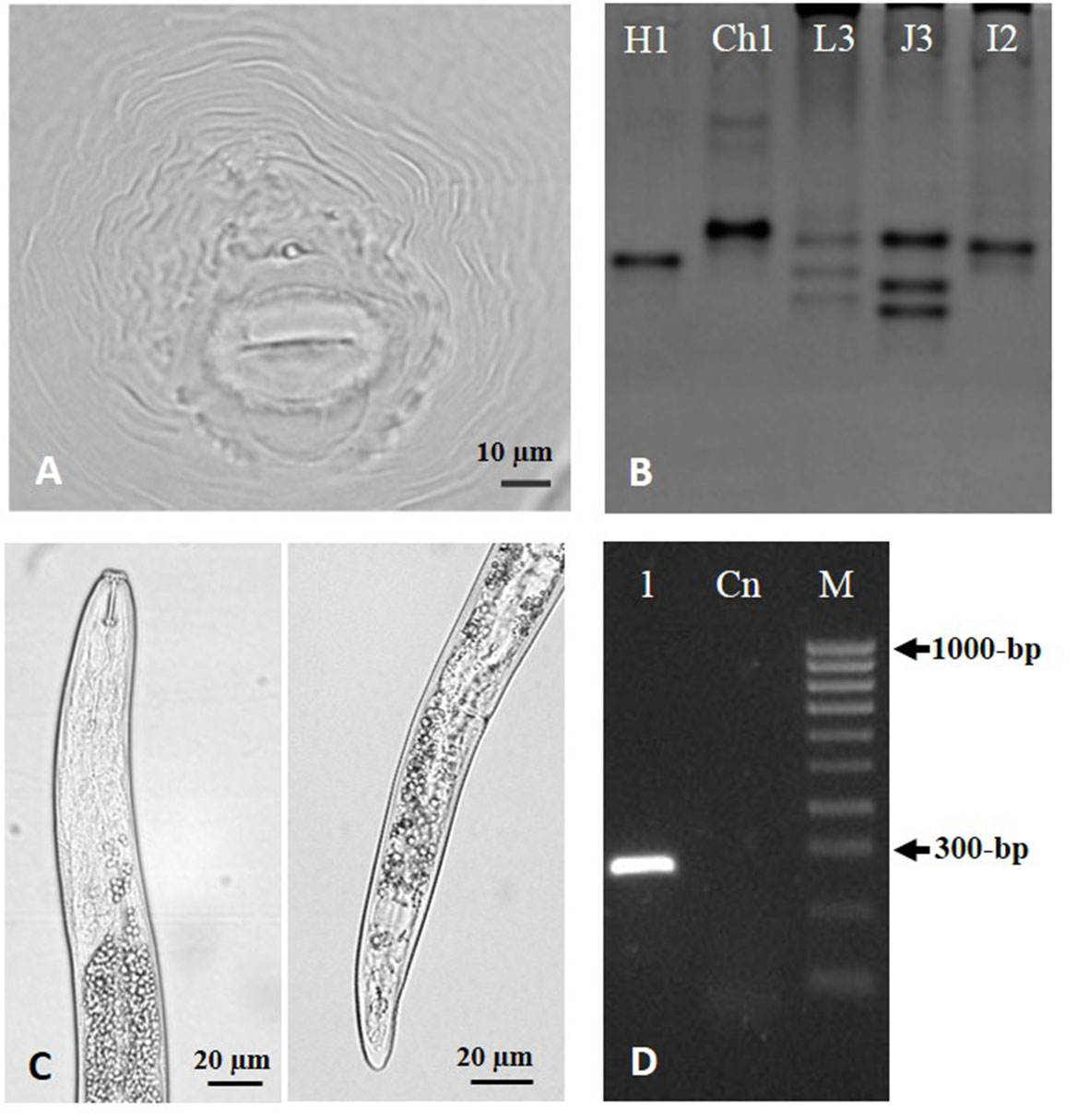
FIGURA 1. A – Fotografia, ao microscópio ótico, de padrão perineal de fêmea de Meloidogyne hispanica; B – Gel de poliacrilamida dos fenótipos de esterases de quatro espécies de Meloidogyne: M. hapla (H1), M. chitwoodi (Ch1), M. luci (L3), M. javanica (J3, isolado de referência) e M. incognita (I2); C – Fotografia, ao microscópio ótico, da cabeça e cauda de fêmea de Pratylenchus spp.; D – Gel de agarose do produto de amplificação (1) obtido para P. thornei usando primers específicos. (Cn- controlo negativo; M- marcador molecular).
Atualmente têm vindo a ser realizados esforços para o desenvolvimento de ferramentas de diagnóstico que, além da rápida deteção e correta identificação, sejam sensíveis, rápidos e baratos. Um dos objetivos do projeto KnowLuci (PTDC/ASP-PLA/31946/2017), financiado pela Fundação para a Ciência e Tecnologia (FCT) através de fundos Nacionais e Europeus, é desenvolver um método molecular, baseado na amplificação de ADN em tempo real (PCR em Tempo Real) para diagnóstico do NGR M. luci, que consiste na duplicação de cadeias de ADN “in vitro” tornando possível, a partir de um único fragmento de ADN, obter milhões de cópias de uma sequência de ADN. O método utiliza um sistema fluorescente que, através de um equipamento especializado, é capaz de detetar e quantificar a luz oriunda da reação de amplificação. Esta abordagem permite não só, a deteção e quantificação de pequenas quantidades de ADN do organismo alvo, mas também a deteção de misturas de espécies e a análise simultânea de um número elevado de amostras, num curto espaço de tempo.
O projeto resulta da colaboração entre investigadores do NEMATO-lab e do Instituto Nacional de Investigação Agrária e Veterinária.
CONTROLO
Os meios de controlo devem ser de tal modo eficazes que diminuam a densidade populacional dos nemátodes no solo para níveis que não causem impacto na produção e qualidade das culturas, sem contudo prejudicar os outros organismos. Apesar da utilização de nematodicidas sintéticos representar um meio eficiente no controlo dos NGR/NLR, estes são dispendiosos e constituem um verdadeiro perigo para o ambiente e para a saúde humana.
Assim, existe necessidade de encontrar alternativas que utilizem agentes biológicos (inoculação de antagonistas de nemátodes como bactérias e fungos, Figura 2A), métodos culturais, e nematodicidas naturais de forma a diminuir a aplicação de nematodicidas sintéticos que garantam a proteção da saúde humana e do ambiente (Zasada et al., 2010; Ntalli & Caboni, 2012; Stirling et al., 2014) (Figura 2).
Alguns dos meios de controlo culturais utilizados contra nemátodes têm sido: 1) destruição dos sistemas radiculares infetados após a colheita; 2) controlo do processo de irrigação para que não haja escorrência; 3) períodos de pousio com eliminação das ervas daninhas; 4) rotação de culturas com plantas não hospedeiras/resistentes/imunes (Figura 2B); e 5) culturas armadilha, como Solanum sisymbriifolium, (Figura 2C) no controlo de NGR e de nemátodes de quisto da batateira. O controlo de NPP através de rotação de culturas baseia-se na resistência das plantas em relação às espécies de nemátodes existentes no local.
A aplicação desta estratégia deve ser feita localmente segundo rotações específicas, na medida em que o solo pode estar infestado com mais do que um tipo de NPP, sendo fundamental a identificação da (s) espécie (s) presentes no campo, recorrendo a métodos de diagnóstico adequados, assim como conhecer a sua gama de plantas hospedeiras. A rotação de culturas deve ter ainda em conta outras doenças e pragas, a fertilidade do solo e a importância económica do produto, tendo sido bem-sucedida quando não é possível a aplicação de métodos mais sofisticados (Whitehead, 1997).
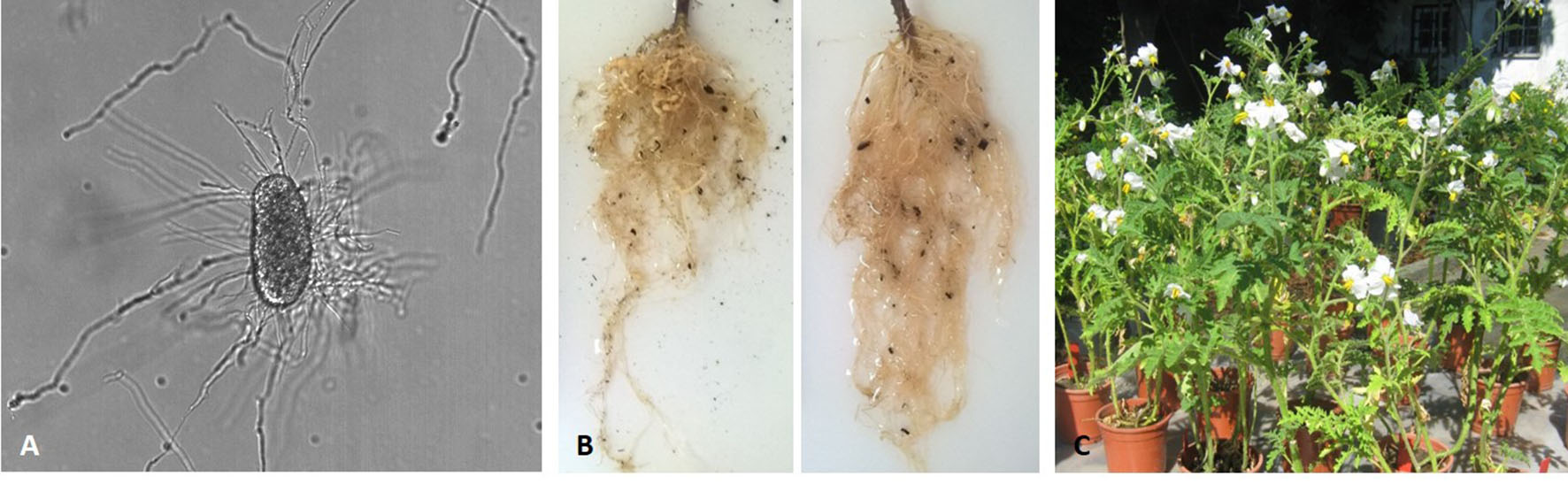
FIGURA 2. A – Ovo de Meloidogyne incognita parasitado pelo fungo nematófago Pochonia chlamydosporia; B – Raízes de tomateiro das cultivares Coração-de-Boi e Amaral, respetivamente, suscetível (esquerda) e resistente (direita) a M. luci (Cortesia de D. Santos); C – Planta armadilha Solanum sisymbriifolium.
Uma vez que as estratégias baseadas no uso de nematodicidas sintéticos se revestem de preocupações ambientais e as estratégias culturais, por vezes, não são completamente eficazes, o desenvolvimento de estratégias alternativas baseadas no uso de nematodicidas naturais tem ganho relevância. Investigadores do NEMATO-lab e do Departamento de Engenharia Química da Universidade de Coimbra, através do projeto BioNem Mulch, financiado pela FCT (PTDC/ASP-PLA/29392/2017), estão a desenvolver uma estratégia inovadora, sustentável e integrada, para culturas em solo coberto com plástico, através do desenvolvimento de sistemas de libertação de nematodicidas naturais totalmente degradáveis, extraídos a partir dos resíduos resultantes do processamento do fruto da nogueira. Esta estratégia ecológica irá contribuir para a melhoria dos sistemas produtivos e de proteção das culturas de forma a limitar as perdas agrícolas devido aos NGR e NLR.
CONCLUSÃO
A crescente procura de alimentos seguros e saudáveis tem estimulado o desenvolvimento de trabalhos de investigação na área da fitonematologia agrícola, sobretudo focada nos NGR e NLR, uma vez que estes fitoparasitas ocorrem com frequência e são muito prejudiciais, sobretudo em sistemas agrícolas que usam práticas de cultivo intensivo, e que exploram excessivamente o uso de nematodicidas sintéticos.
Neste momento, encontram-se em curso dois projetos de investigação que visam o desenvolvimento de métodos moleculares para diagnóstico e deteção precoce do NGR M. luci e a implementação de estratégias de controlo alternativas baseadas no uso de nematodicidas naturais.
O conhecimento gerado irá ser fundamental para delinear procedimentos regulatórios que evitem a disseminação destes organismos e, ao limitar as aplicações de pesticidas, contribuirão para aumentar a eficiência dos sistemas de produção agrícola, levando não apenas a maiores rendimentos, mas também à melhoria da qualidade dos produtos.
AGRADECIMENTOS
Projetos UIDB/04004/2020, UIDB/00102/2020, PTDC/ASP-PLA/31946/2017, PTDC/ASP-PLA/29392/2017 e Centro-01-0145-FEDER-000007, financiados por fundos FEDER no âmbito do PT2020, COMPETE 2020 e pela FCT, e ao IATV.
BIBLIOGRAFIA
CARNEIRO, R.M., de OLIVEIRA LIMA, F.S., CORREIA, V.R. Methods and tools currently used for the identification of plant parasitic nematodes. 2017. In: Shah, M.M., Mahamood, M. (Eds.). Nematology‐concepts, diagnosis and control. IntechOpen, pp. 19-35.
EPPO - EPPO A2 List of pests recommended for regulation as quarantine pests. Sep 2020. [20 Oct 2020]. Disponível em https://www.eppo.int/ACTIVITIES/plant_quarantine/A2_list
FAO. 2018. The future of food and agriculture – Alternative pathways to 2050. Summary version. Rome.
MALEITA, C., ESTEVES, I., CARDOSO, J.M.S., CUNHA, M.J., CARNEIRO, R.M.D.G., ABRANTES, I. Meloidogyne luci, a new root-knot nematode parasitising potato in Portugal. Plant Pathology 67 (2018), 366-376.
NTALLI, N.G, CABONI, P. Botanical Nematicides: A Review. Journal of Agricultural and Food Chemistry 60 (2012), 9929-9940.
PAIS, C.S., ABRANTES, I.M. de O. Esterase and malate dehydrogenase phenotypes in Portuguese populations of Meloidogyne species. Journal of Nematology 21 (1989), 342–346.
SANTOS, D., CORREIA, A., ABRANTES, I., MALEITA, C. New hosts and records in Portugal for the root-knot nematode Meloidogyne luci. Journal of Nematology 51 (2019) e2019-03.
STIRLING, G.R., 2014. Biological control of plant-parasitic nematodes: soil ecosystem management in sustainable agriculture. 2nd Edition. CABI Publishing.
WHITEHEAD, A.G., 1997. Plant Nematode Control. New York, USA, CABI Publishing.
ZASADA, I.A., HALBRENDT, J.M., KOKALIS-BURELLE, N., LAMONDIA, J., MCKENRY, M.V., NOLING, J. W. Managing nematodes without methyl bromide. Annual Review of Phytopathology 48 (2010), 311-328.
Nota de Redação:
Em alternativa, contacte-nos através dos seguintes endereços:
Telefone 225899620
E-mail: redacao@agropress.pt